Concepto moderno del átomo: modelo de Bohr
1. Modelo de Bohr
En la primera mitad del siglo XX se realizaron unos descubrimientos que no podían ser explicados con el modelo de Rutherford. El físico N. Bohr propone un modelo en el que los electrones sólo pueden ocupar ciertas órbitas circulares a similitud de las órbitas de los planetas. Los electrones se organizan en capas, y en cada capa tendrán una cierta energía, llenando siempre las capas inferiores (de menor energía) y después las superiores.
En 1913 formuló una hipótesis sobre la estructura atómica en la que estableció tres postulados:
1. El electrón no puede girar en cualquier órbita, sino sólo en un cierto número de órbitas estables. En el modelo de Rutherford se aceptaba un número infinito de órbitas.
2. Cuando el electrón gira en estas órbitas no emite energía.
3. Cuando un átomo estable sufre una interacción, como puede ser el impacto de un electrón o el choque con otro átomo, uno de sus electrones puede pasar a otra órbita estable o ser arrancado del átomo.
La distribución de los electrones en las capas se denomina configuración electrónica y se realiza de la siguiente manera:
- La 1ª capa puede contener, como máximo, 2 electrones.
- La 2ª capa puede contener, como máximo, 8 electrones. Comienza a llenarse una vez que la 1ª ya está completa.
- La 3ª capa puede contener, como máximo, 18 electrones. Comienza a llenarse una vez que la 2ª capa ya está completa.
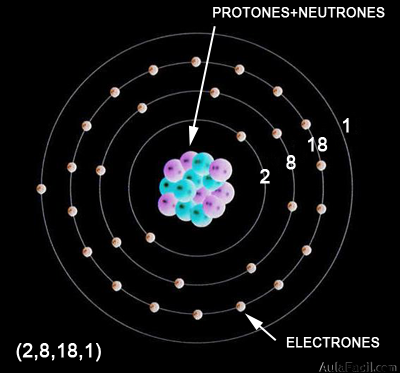
El número de electrones en cada capa se representa entre paréntesis y separados por comas.
Por ejemplo, un átomo que tenga 11 electrones los distribuye así:
(2,8,1). Es decir, 2 electrones en la capa 1, 8 electrones en la capa 2 y 1 electrón en la capa 3.