Disoluciones
1. Disoluciones
Una disolución es un sistema material homogéneo formado por la mezcla de dos o más sustancias.
Al componente mayoritario de una disolución se le denomina disolvente, mientras que al resto de componentes se les conoce como solutos.
2. Tipos de disoluciones
Antes de hablar de los tipos de disoluciones existentes debemos conocer un concepto que nos va a ayudar a entender la clasificación de las disoluciones.
Solubilidad: llamamos solubilidad de una sustancia a la máxima cantidad de esa sustancia que se puede disolver en una cantidad de disolvente a una temperatura determinada. Cuanto mayor sea la temperatura, mayor será la solubilidad de una sustancia.
Así podemos entender los siguientes tipos de disoluciones:
- 1. Disolución diluida: es aquella disolución donde la cantidad de soluto está muy alejada de su solubilidad.
- 2. Disolución concentrada: es aquella disolución donde la cantidad de soluto está muy cerca de su solubilidad.
- 3. Disolución saturada: es aquella disolución que no admite más soluto.
- 4. Disolución sobresaturada: es aquella disolución que presenta más soluto del que puede admitir, para ello habrá que subir la temperatura de la mezcla.
3. Concentración de una disolución
La concentración de una disolución es una magnitud que nos informa sobre la cantidad de soluto presente en la disolución. Existen muchas formas de expresar la concentración de una disolución, nosotros nos vamos a detener en dos:
Composición porcentual en masa: hace referencia al tanto por ciento en masa de soluto en la disolución.
Por ejemplo: tenemos una disolución de cloruro sódico en agua al 30%, quiere decir que de cada 100g de disolución 70g corresponden al agua y 30g al sodio.Relación masa-volumen: expresa el número de gramos de soluto que hay por litro de disolución (g/L).
Por ejemplo: tenemos una disolución de cloruro sódico en agua de 20g/L, quiere decir que por cada litro de agua hay una concentración de 20g de sodio.
4. Métodos de separación de mezclas
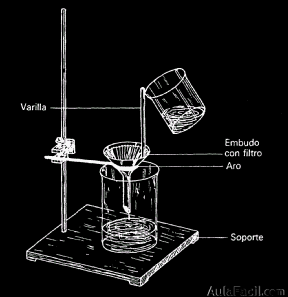
1. Filtración: se utiliza para separar mezclas formadas por sólidos insolubles en un líquido. El sólido queda retenido en el filtro.
2. Centrifugación: se utiliza para separar mezclas formadas por sólidos insolubles y un líquido. Es más preciso que la filtración. Se utiliza una centrifugadora que hace girar a los tubos de muestra de tal manera que las partículas sólidas finalizan en el fondo de los tubos al final del proceso.
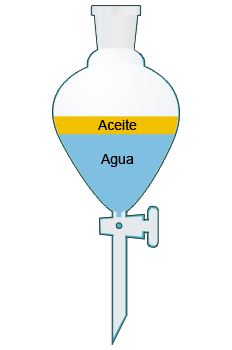
3. Decantación: se utiliza para separar mezclas formadas por dos líquidos no miscibles. Utilizaremos un embudo de decantación.
4. Cristalización: su objetivo principal es cristalizar el soluto de una solución por evaporación del solvente. Se lleva a cabo en un recipiente de base ancha que recibe el nombre de cristalizador.
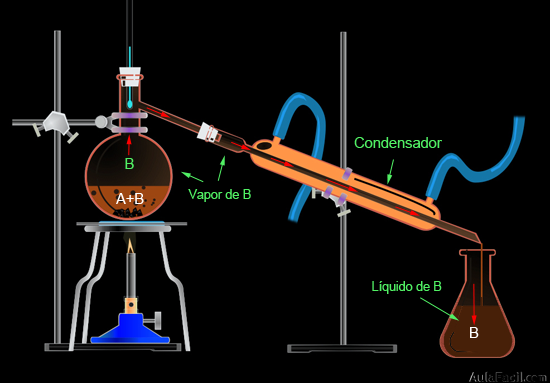
5. Destilación simple: se utiliza para separar mezclas de sólidos solubles en líquidos, así como las mezclas de dos líquidos miscibles y con diferentes punto de ebullición que difieran al menos en 25ºC.
Este método requiere un montaje algo más complejo que los anteriores métodos, ya que se necesita un mayor número de material de laboratorio:
- 1. Colocamos la mezcla de dos líquidos miscibles (A y B) de distinto punto de ebullición en el matraz.
- 2. Al calentar la mezcla, el líquido de menor punto de ebullición (B) comenzará a vaporizarse, mantendremos constante esa temperatura para que no vaporice el líquido A.
- 3. El vapor de B sube por el matraz y llega al condensador, donde disminuye su temperatura debido al contacto que experimenta con las paredes frías del tubo por donde circula agua, con lo que el vapor de B condensa y vuelve a estado líquido.
- 4. El líquido de B resbala por el tubo del condensador y cae en el matraz de destilado. Entendemos que la destilación ha concluido cuando deja de gotear líquido B en el matraz de destilado.
- 5. Ya podemos observar como los líquidos A y B están perfectamente separados.