Los gases y la Teoría Cinética: leyes de los gases
1. Ley de Boyle-Mariotte
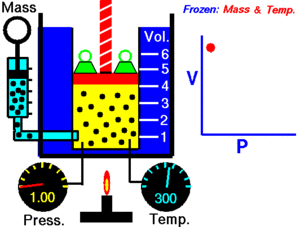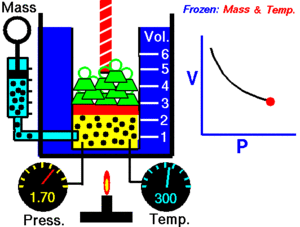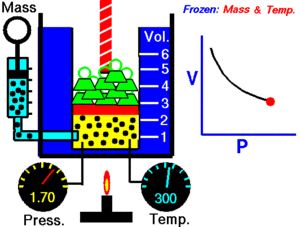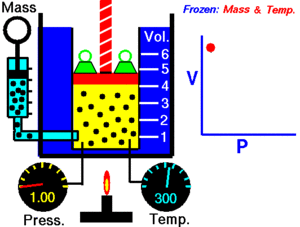
A temperatura constante, el volumen de una masa fija de gas es inversamente proporcional a la presión que éste ejerce.
Matemáticamente se puede expresar así:
PV=K
K es constante si la temperatura y la masa del gas permanecen constantes.
Autor : NASA's Glenn Research Center
Cuando aumenta la presión, el volumen baja, mientras que si la presión disminuye el volumen aumenta.
Manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
P1 x V1=P2 x V2
donde:
P1= Presión inicial
P2= Presión final
V1= Volumen inicial
V2= Volumen final
2. Ley de Gay-Lussac
Si el volumen de una cierta cantidad de gas a presión moderada se mantiene constante, el cociente entre presión y temperatura (Kelvin) permanece constante.
Para una cierta cantidad de gas, al aumentar la temperatura las moléculas del gas se mueven más rápidamente, y por lo tanto aumenta el número de choques contra las paredes por unidad de tiempo; es decir, aumenta la presión, ya que el recipiente es de paredes fijas y su volumen no puede cambiar.
Gay-Lussac descubrió que en cualquier momento del proceso, el cociente entre la presión y la temperatura absoluta tenía un valor constante.
Lo podemos expresar numéricamente:
o también:
donde:
P es la presión
T es la temperatura absoluta (es decir, medida en Kelvin)
K2 la constante de proporcionalidad
Supongamos que tenemos un gas que se encuentra a una presión P1 y a una temperatura T1 al comienzo del experimento. Si variamos la temperatura hasta un nuevo valor T2, entonces la presión cambiará a P2, y se cumplirá:
donde:
P1= Presión inicial
T1 = Temperatura inicial
P2 = Presión final
T2 = Temperatura final
3. Ley de Charles
La ley Jacques Charles dice que :
Para una cierta cantidad de gas a una presión constante, al aumentar la temperatura, el volumen del gas aumenta y al disminuir la temperatura, el volumen del gas disminuye.
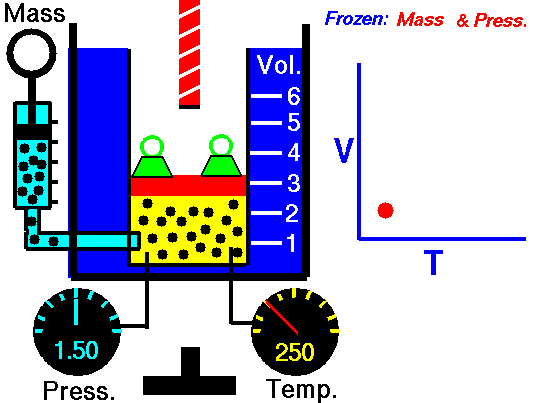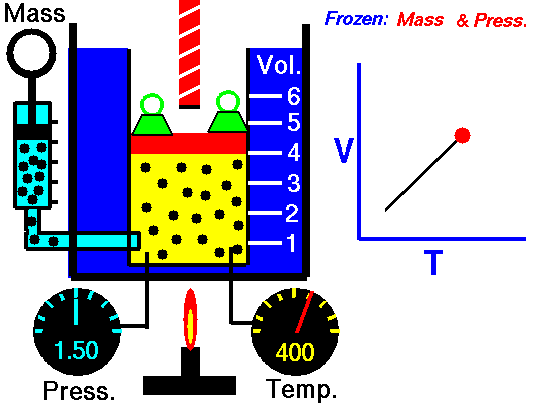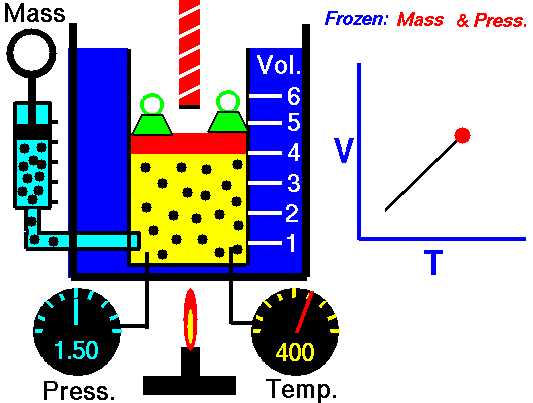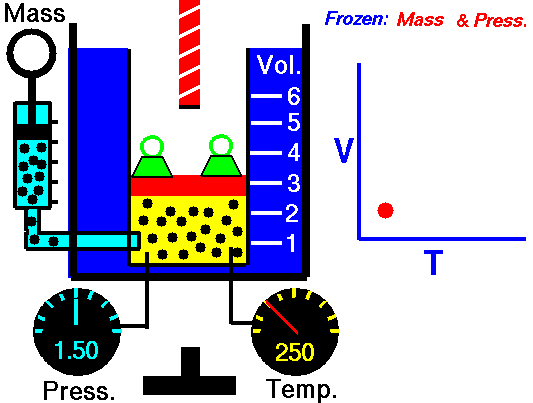
Autor : NASA's Glenn Research Center
Lo podemos expresar:
Además puede expresarse como:
donde:
V1= Volumen inicial
T1= Temperatura inicial
V2= Volumen final
T2= Temperatura final