Los gases y la Teoría Cinética: presión
1. Presión
Llamaremos "presión" a la fuerza por unidad de superficie que ejercen las partículas del gas al chocar contra las paredes del recipiente.
1.1 Unidades
Se define la magnitud física llamada Presión como una fuerza por unidad de superficie, es decir:
Su unidad en el Sistema Internacional, es el Pascal (Pa) y equivale a la presión que ejerce una fuerza de 1 newton sobre una superficie de 1 m2 normal a la misma:
El Pa es una unidad de presión muy pequeña, por lo que se suelen usar otras unidades de presión. Entre ellas tenemos:
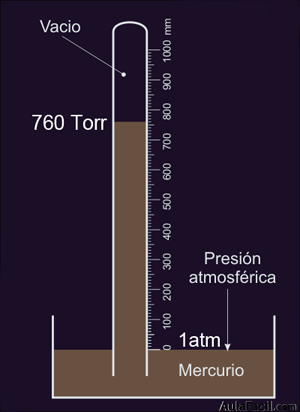
La atmósfera cuyo símbolo será atm y que equivale a una cantidad de Pascales de: 1 atm = 101.325 Pa, o lo que es lo mismo, 1013 hPa (hectopascal). El hPa se llamaba antes milibar.
Por último también se utiliza el Torr (Evangelista Torricelli) que equivale a la presión ejercida en la base de una columna de un milímetro de altura de mercurio, con lo que: 1 atm = 101325 Pa = 1013 hPa = 760 Torr
1.2 Factores que regulan la presión
La presión que ejerce un gas sobre las paredes del recipiente, depende de tres factores:
1. Del nº de partículas de gas (cantidad de gas considerada). A más partículas más presión.
2. Del volumen del recipiente. A mayor volumen, menor presión.
3. De la temperatura del gas. A mayor temperatura, mayor velocidad de las partículas del gas y por tanto mayor presión.