Reacción química
1. Reacción química
Recordemos los tipos de cambios que experimenta la materia, pueden ser de dos tipos:
- Cambios físicos: son aquellos en los que no se altera la naturaleza (composición) de la sustancia que cambia. Por ejemplo: los cambios de estado.
- Cambios químicos: son aquellos en los que si se altera la naturaleza (composición) de la sustancia que cambia. Por ejemplo: una oxidación.
Todo cambio químico tiene lugar a través de una reacción química. Una reacción química es un proceso por el que una sustancia inicial, llamada "reactivo", se transforma en otra distinta llamada "producto".
Las reacciones químicas se representan mediante ecuaciones químicas, en el primer miembro escribiremos los reactivos y en el segundo miembro los productos.
Reactivos → Productos
HCl + Zn → ZnCl2 + H2
Así vemos que la reacción anterior presenta como reactivos el cloruro de hidrógeno y el cinc, y como productos, hidrógeno y cloruro de zinc. Se puede leer de la siguiente forma: el cloruro de hidrógeno reacciona con el zinc para dar lugar a hidrógeno y cloruro de zinc.
En ocasiones resulta recomendable expresar el estado de agregación en el que se encuentran las sustancias participantes en la reacción, para ello utilizaremos los siguientes subíndices:
(s) → estado sólido
(l) → estado líquido
(g) → estado gaseoso
(dis) → en disolución
Por ejemplo:
Carbonato cálcico (S) → óxido cálcico (S) + dióxido de carbono (g)
CaCO3 (S) →CaO (S) + CO2 (g)
Vemos como el carbonato de calcio en estado sólido se descompone para dar lugar a óxido de calcio sólido y dióxido de carbono gaseoso.
1.1 Ajuste de reacción química
De acuerdo con la Teoría atómica de Dalton, en las reacciones químicas los átomos ni se crean ni se destruyen, por lo tanto debe existir el mismo número de átomos de cada elemento en los reactivos y en los productos.
Sin embargo, en ocasiones vemos que el número de partículas no coincide con el resultado final de la fórmula.
Esto se debe a que las moléculas no tienen por qué reaccionar 1:1, sino que pueden reaccionar en otra proporción. Para ello ajustaremos la reacción asignando números, llamados coeficientes estequiométricos, delante de cada sustancia participante hasta comprobar que el número de átomos coincide.
Por ejemplo: el metano reacciona con el oxígeno gaseoso para dar lugar dióxido de carbono y agua.
Si escribimos la ecuación, tal cual, vemos que no coinciden el número de partículas del producto con el de los reactivos.
Obtenemos:

Reactivos:
1 átomo de carbono
2 átomos de oxígeno
4 átomos de hidrógeno
Productos:
1 átomo de carbono
3 átomos de oxígeno
2 átomos de hidrógeno
Aplicando el ajuste tenemos (observa el número "2" que agregamos delante de O2 y H2O, es el coeficiente estequiométrico):
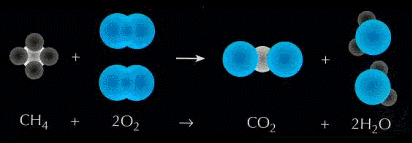
Reactivos:
1 átomo de carbono
4 átomos de oxígeno
4 átomos de hidrógeno
Productos:
1 átomo de carbono
4 átomos de oxígeno
4 átomos de hidrógeno
El número de partículas de productos coincide con el de reactivos.