Identificación del átomo
1. Número atómico y número másico
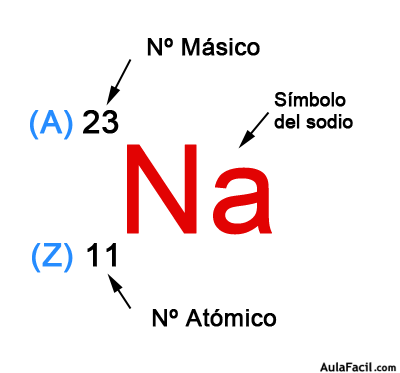
El número atómico de un átomo representa el número de protones que tiene dicho átomo.
Se representa mediante la letra “Z”. Se coloca como subíndice a la izquierda del símbolo del elemento correspondiente.
El número másico representa el número total de partículas del núcleo, es decir, el número de protones más el número de neutrones, y se representa mediante la letra “A”.
Se sitúa como superíndice a la izquierda del símbolo del elemento.
Representa, aproximadamente la masa del átomo medida en uma (unidad de masa atómica), ya que la de los electrones es tan pequeña que puede despreciarse.
2. Isótopos
Los isótopos son átomos de un mismo elemento químico que tienen igual número atómico pero distinto número másico, es decir, se diferencian en el número de neutrones.
Por tanto, presentan el mismo número atómico (Z) y diferente número másico (A).
Los isótopos tienen masa diferente, ya que tienen distinto número de neutrones.
Para nombrarlos se indica su nombre seguido de su número másico.
Por ejemplo: sodio-23(Na-23), hidrógeno-3 (H-3), carbono-14 (C-14).
3. Iones
Un ión es un átomo con carga eléctrica como consecuencia de haber ganado o perdido electrones.
Si el átomo pierde electrones se carga positivamente, y el ión que resulta se llama catión, y adquirirá tanta carga positiva como electrones pierda.
Si por el contrario el átomo gana electrones, se cargará negativamente y el ión que se forma recibe el nombre de anión, y adquirirá tanta carga negativa como electrones gane.
Se indica con un superíndice a la derecha, si es positivo es que ha perdido electrones y si es negativo es que los ha ganado.
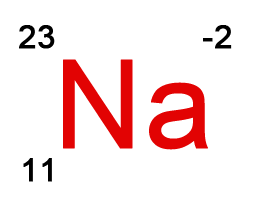
En este caso vemos que el elemento Sodio (Na) ha ganado dos electrones, con lo cual el número total de electrones será 13 (recordemos que un átomo con carga neutra tendrá el mismo número de electrones que de protones).
4. Masa del átomo
Como el átomo es tan pequeño, no resulta útil usar como unidad de masa ni el kilogramo, ni el gramo, etc... en química se usa la denominada “Unidad de masa atómica” (“u.m.a.” o “u”) para expresar la masa de un átomo, esta unidad se define como “la doceava parte de la masa de un átomo de carbono 12”.
1u = 1,6606·10-27Kg
Como consideración general de la masa del átomo se definen dos reglas:
- La masa de un átomo de un elemento químico se obtiene de la media ponderal de las masas atómicas de los distintos isótopos de dicho elemento.
- La masa de una molécula se calcula sumando las masas de los átomos que la componen.