Modelos atómicos
1. Modelo atómico de Thomson
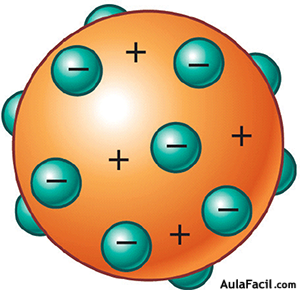
Al ser tan pequeña la masa de los electrones, el físico inglés J. J. Thomson propuso en 1904 que la mayor parte de la masa del átomo correspondería a la carga positiva, que ocuparía la mayor parte del volumen atómico. Thomson imaginó el átomo como una especie de esfera positiva continua en la que se encuentran incrustados los electrones, más o menos como las uvas pasas en un pudin.
Este modelo de "pudin de pasas" de Thomson fue bastante valorado ya que era capaz de explicar los siguientes fenómenos:
- La electrización: el exceso o defecto de electrones que tenga un cuerpo es el responsable de su carga negativa o positiva.
- La formación de iones: un ión es un átomo que ha ganado o perdido uno o más electrones. Los electrones se pierden o se ganan con relativa facilidad, de manera que su número dentro del átomo puede variar, mientras que el número de protoneses fijo siempre para cada átomo. Si un átomo pierde uno o más electrones adquiere carga neta positiva (catión), y si gana uno o más electrones adquiere carga neta negativa (anión).
2. Insuficiencia del modelo de Thomson
El átomo no es macizo ni compacto como suponía Thomson, es prácticamente hueco y el núcleo es muy pequeño comparado con el tamaño del átomo, según demostró posteriormente E. Rutherford.
3. Modelo atómico de Rutherford
El modelo de Rutherford (1911) fue el primer modelo atómico que consideró al átomo formado por dos partes:
- El núcleo, muy pequeño, que concentra toda la carga eléctrica positiva y la mayor parte de la masa del átomo, aportada por los protones y neutrones.
- La corteza, constituida por todos sus electrones, que giran a gran velocidad alrededor del núcleo.
La carga positiva de los protones es compensada con la carga negativa de los electrones, que se hallan fuera del núcleo. El núcleo contiene, por tanto, protones en un número igual al de electrones de la corteza.

Rutherford no solo dio una idea de cómo estaba organizado un átomo, sino que también calculó cuidadosamente su tamaño (un diámetro del orden de 10-10 m) y el de su núcleo (un diámetro del orden de 10-14m).
El hecho de que el núcleo tenga un diámetro unas 10.000 veces menor que el átomo supone una gran cantidad de espacio vacío en la organización atómica de la materia.
4. Modelo de Bohr
En la primera mitad del siglo XX se realizaron unos descubrimientos que no podían ser explicados con el modelo de Rutherford. El físico N. Bohr propone un modelo en el que los electrones sólo pueden ocupar ciertas órbitas circulares, a similitud de las órbitas de los planetas. Los electrones se organizan en capas y, en cada capa tendrán una cierta energía, llenando siempre las capas inferiores (de menor energía) y después las superiores.
En 1913 formuló una hipótesis sobre la estructura atómica en la que estableció tres postulados:
1. El electrón no puede girar en cualquier órbita, sino sólo en un cierto número de órbitas estables. En el modelo de Rutherford se aceptaba un número infinito de órbitas.
2. Cuando el electrón gira en estas órbitas no emite energía.
3. Cuando un átomo estable sufre una interacción, como puede ser el impacto de un electrón o el choque con otro átomo, uno de sus electrones puede pasar a otra órbita estable o ser arrancado del átomo.
La distribución de los electrones en las capas se denomina configuración electrónica, y se realiza de la siguiente manera:
- La 1ª capa puede contener, como máximo, 2 electrones.
- La 2ª capa puede contener, como máximo, 8 electrones. Comienza a llenarse una vez que la 1ª ya está completa.
- La 3ª capa puede contener, como máximo, 18 electrones. Comienza a llenarse una vez que la 2ª capa ya está completa.
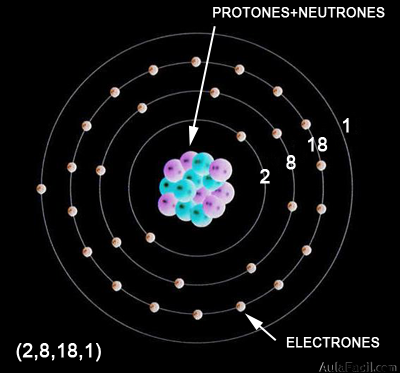
El número de electrones en cada capa se representa entre paréntesis y separados por comas.
Por ejemplo: un átomo que tenga 11 electrones, los distribuye así:
(2,8,1). Es decir, 2 electrones en la capa 1, 8 electrones en la capa 2 y 1 electrón en la capa 3.